Une fois les autres causes d’inefficacité du PPP éliminée, il est nécessaire de réaliser des tests de résistance pour avoir confirmation de la présence d’une résistance chez un bio-agresseur. Ces tests sont le plus souvent effectués en conditions contrôlées (laboratoire, serre…). Pour les herbicides, s’il s’agit d’un cas de résistance déjà caractérisé, de tels tests peuvent ensuite être effectués au champ.
La résistance est généralement quantifiée en exposant le bio-agresseur à une ou plusieurs doses d’un PPP, en conditions contrôlées. On mesure l’effet de ces doses sur un trait phénotypique du bio-agresseur. Ce trait peut-être la croissance mycélienne, l’élongation du filament, la germination ou la sporulation chez les champignons, la survie ou la croissance chez les adventices ou les insectes (figure 5a).
figure 5a : Une illustration d’un test biologique de résistance au glyphosate de type « dose-réponse » sur ray-grass (Lolium rigidum). Les graines pré-germées sont mises en plaques de 12 × 8 puits. Dans les colonnes de la plaque de gauche à droite se trouvent des doses croissantes du PPP. La colonne à l’extrême gauche est le témoin ne contenant pas de PPP. Le caractère mesuré est la croissance de la première feuille de la plante. Plus la concentration est élevée, moins la plante croît.
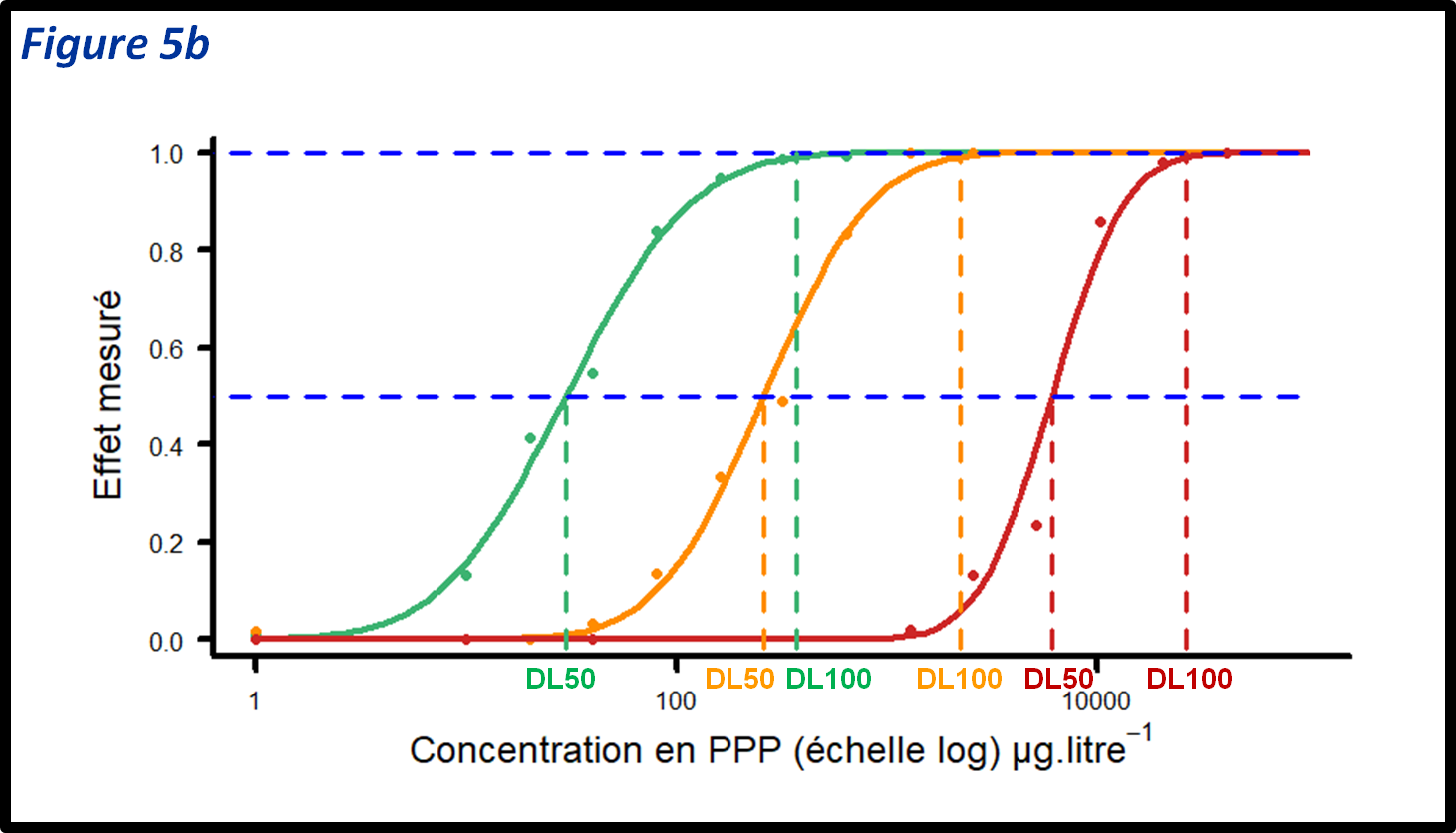
Un premier type de test est basé sur l’analyse de la réponse à la dose (figure 5a), ce qui peut permettre d’évaluer la concentration du produit phytosanitaire qui a un effet sur le phénotype de 50% de l’effet maximum observé (figure 5b). Ce type de test peut aussi être employé de manière exploratoire, pour déterminer la plus petite dose qui a un effet de 100% sur le bio-agresseur, par exemple la CMI (Concentration Minimale Inhibitrice) chez les champignons ou la DL100 (Dose Létale pour 100% des individus) chez les insectes et les adventices (figure 5b). La DL100 peut ensuite être utilisée comme dose discriminante (voir figure 5c) dans les tests de routine.
figure 5b : Détermination des doses de PPP qui ont un effet de 50% ou 100% du maximum de l’effet observé. On parle de DL50 (Dose Létale pour 50% des individus) ou de CI50 (Concentration Inhibitrice à 50% du maximum de l’effet mesuré), et de DL100 (Dose Létale pour 100% des individus) ou de CMI (Concentration Minimale Inhibitrice) selon les bio-agresseurs et les traits mesurés. Les tests biologiques de type « dose-réponse » sont les seuls qui permettent d’évaluer ces valeurs. Chaque courbe représente la réponse de la mesure du trait en pourcentage de l’effet maximum observé en fonction de la concentration en PPP d’un individu. Un individu sensible (courbe verte) aura une DL50 (CI50) et une DL100 (CMI faibles et un individu résistant (courbe rouge) aura une DL50 (CI50) et une DL100 (CMI) élevées. Les niveaux de résistance sont variables et des individus à la résistance intermédiaire existent (courbe orange).
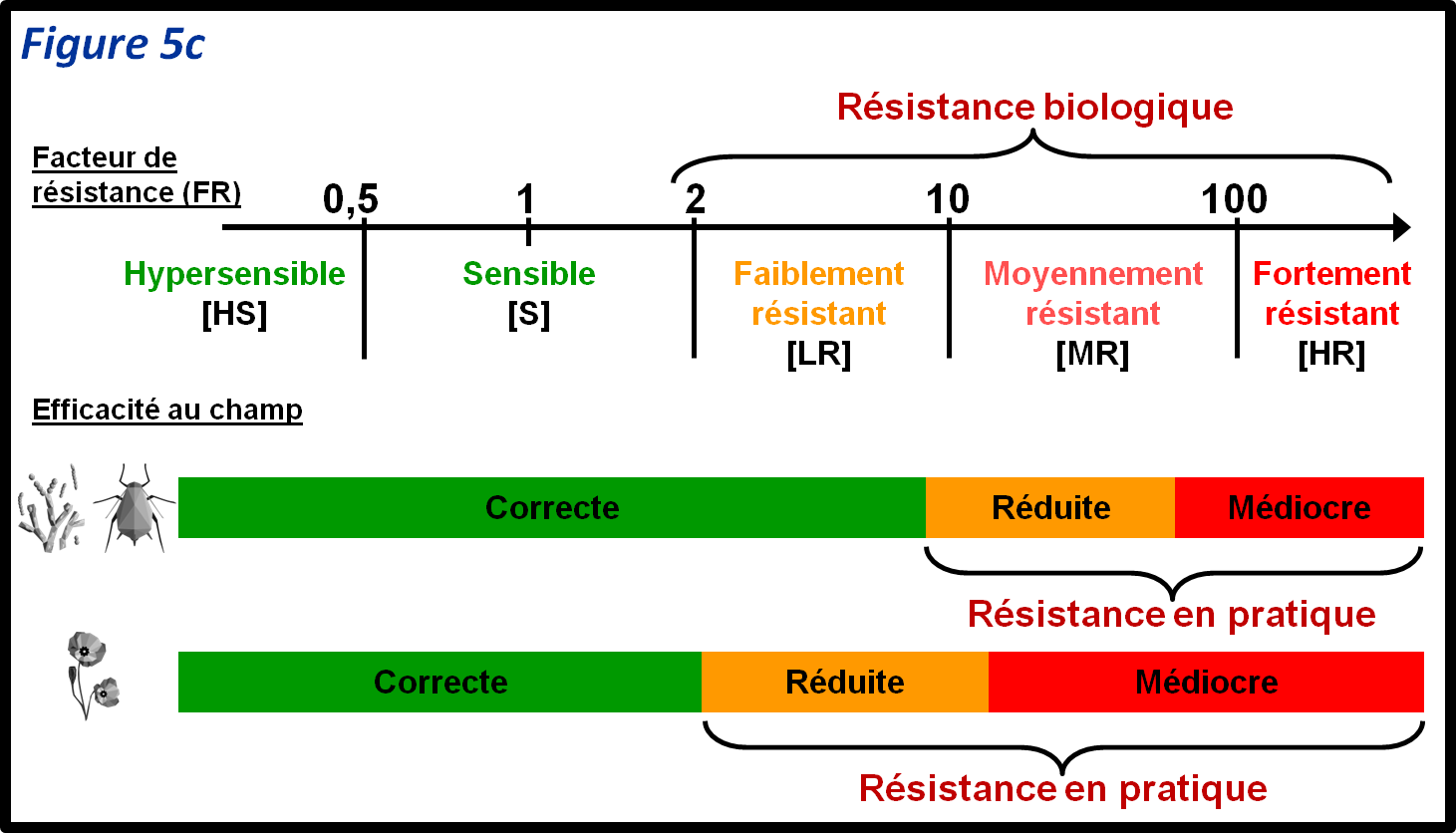
Le rapport des doses d’un PPP nécessaires pour obtenir le même effet sur des individus résistants en comparaison des individus sensibles de référence s’appelle le facteur de résistance (ou FR). Le FR permet d’estimer l’intensité de la résistance d’un individu par rapport à une référence sensible. La valeur de FR qui peut conduire à une résistance en pratique diffère selon les catégories de bio-agresseur. Des FR de 2 peuvent conduire à des pertes de contrôle au champ pour des adventices, alors que la résistance en pratique ne s’observera que pour des FR bien supérieurs pour les champignons et les insectes (figure 5d). Il faut toutefois garder à l’esprit qu’il n’y a pas que le niveau de résistance qui est important, mais également la fréquence des individus résistants dans les populations de bio-agresseur.
figure 5c : Le rapport entre les DL50 (CI50) d’un échantillon et la DL50 (CI50, respectivement) d’un échantillon de référence sensible s’appelle le facteur de résistance (FR). Il permet d’estimer le niveau relatif de la résistance biologique (c’est-à-dire la résistance mesurée au laboratoire) de l’échantillon. Idéalement, ce calcul se fait sur une moyenne d’échantillons de référence. Cette valeur est indicative car elle dépend beaucoup de la valeur de référence. Elle permet toutefois une première évaluation du potentiel d’évolution vers une résistance en pratique (c’est-à-dire une résistance au champ) du bio-agresseur : un individu avec un fort FR aura une plus forte probabilité d’aboutir à terme à une situation de perte d’efficacité au champ.
Un second type de tests biologiques est basé sur l’application d’une dose discriminante de PPP. Tout individu survivant à cette dose appliquée en conditions contrôlées est considéré comme résistant. La dose discriminante peut être la CMI ou DL100 obtenue par l’analyse de la réponse à la dose. Toutefois, pour les adventices, c’est généralement la dose maximale autorisée au champ, appliquée sur des plantes entières au stade recommandé pour l’application au champ, qui est utilisée comme dose discriminante.
Les tests biologiques sont essentiels pour la détection ou la confirmation initiale de cas de résistance. Il existe cependant d’autres types de tests de détection des résistances : les tests biochimiques et les tests « moléculaires ». Les trois grands types de tests sont décrits plus en détails dans la partie «Détection de la résistance».
Un individu peut être résistant à plusieurs substances actives différentes. La liste des substances auxquels l’individu est résistant est appelé « profil de résistance » ou « spectre de résistance ». Les bases génétiques sur lesquelles reposent les spectres de résistances sont de deux types :
- si la résistance à plusieurs substances actives est due à une même mutation, on parle de résistance croisée. Par extension, on peut parler de résistance croisée quand un même mécanisme de résistance confère une résistance à plusieurs substances actives. Un cas particulier de résistance croisée est la résistance multidrogues (ou MDR) des champignons, où une mutation affectant un même transporteur membranaire induit un efflux accru de différents PPP ;
- si la résistance à plusieurs substances actives différentes est due à plusieurs mutations, différentes pour les différentes substances, on parle de résistance multiple. Par extension, on peut parler de résistance multiple quand une résistance à des substances actives différentes est due à des mécanismes de résistance différents.
Comme déjà précisé, la résistance repose sur des bases génétiques. Elle est donc héritable.
Une résistance croisée, qui est due à une seule mutation, est transmise en bloc à la descendance de l’individu résistant, quel que soit le mode de reproduction du bio-agresseur. Une résistance multiple, qui est due à plusieurs mutations, pourra, par contre, être dissociée dans la descendance issue d’une reproduction sexuée. Tous les descendants n’hériteront pas forcément de toutes les mutations de leurs parents, et pourront donc avoir des spectres de résistance variables d’un descendant à l’autre.
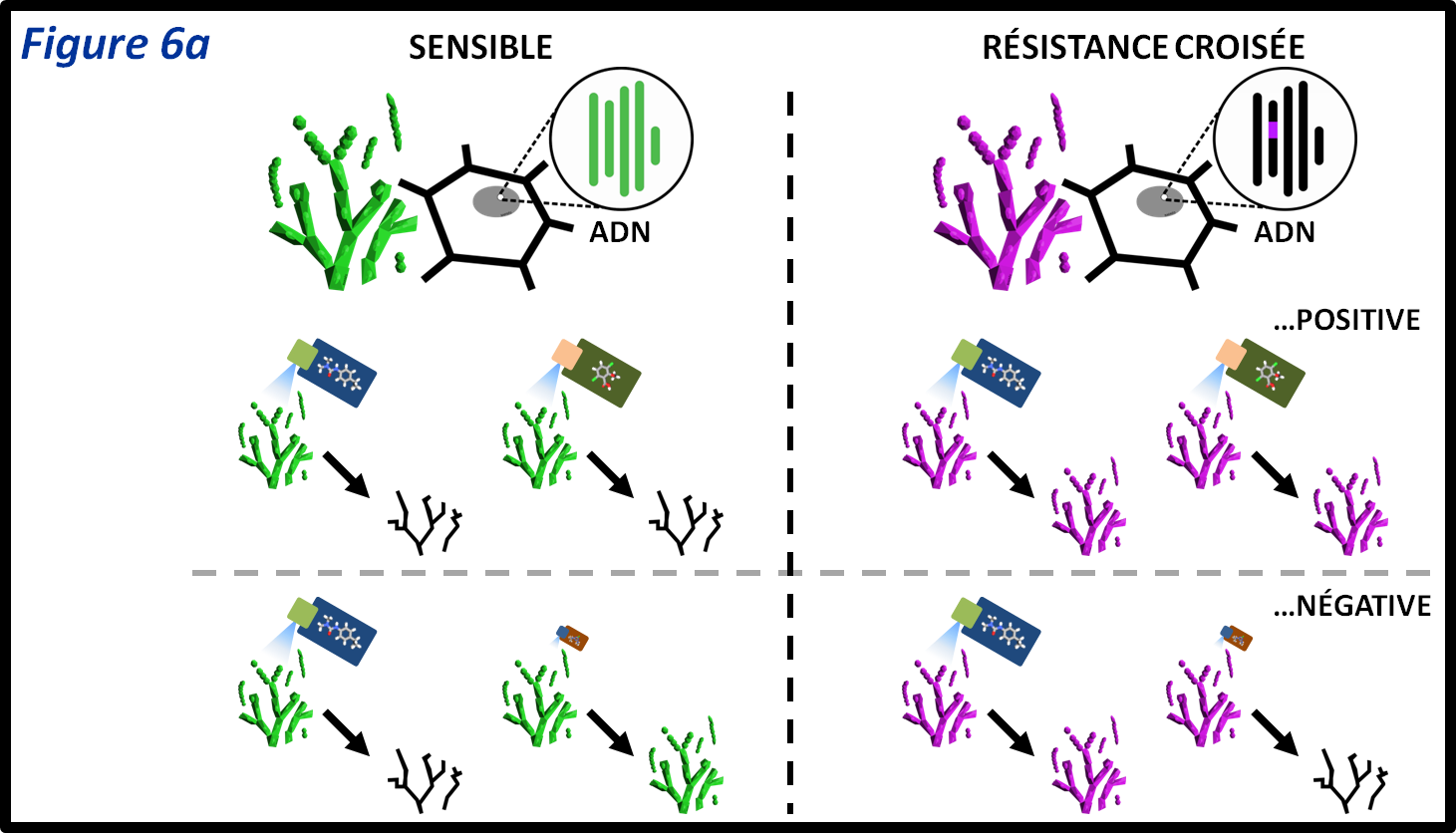
figure 6a : Lorsqu’une même mutation confère une résistance à plusieurs substances actives on parle de résistance croisée. Dans le cas théorique de ce champignon haploïde, la mutation ‘violette’ confère une résistance à deux PPP. On parle de résistance croisée positive. Il arrive qu’une mutation confère une résistance à un PPP mais rende l’individu hypersensible à un autre (il est tué par une dose plus petite que celle tuant un individu sensible). La mutation “violette” rend le champignon résistant au premier PPP, mais hypersensible au second. On parle alors de résistance croisée négative.
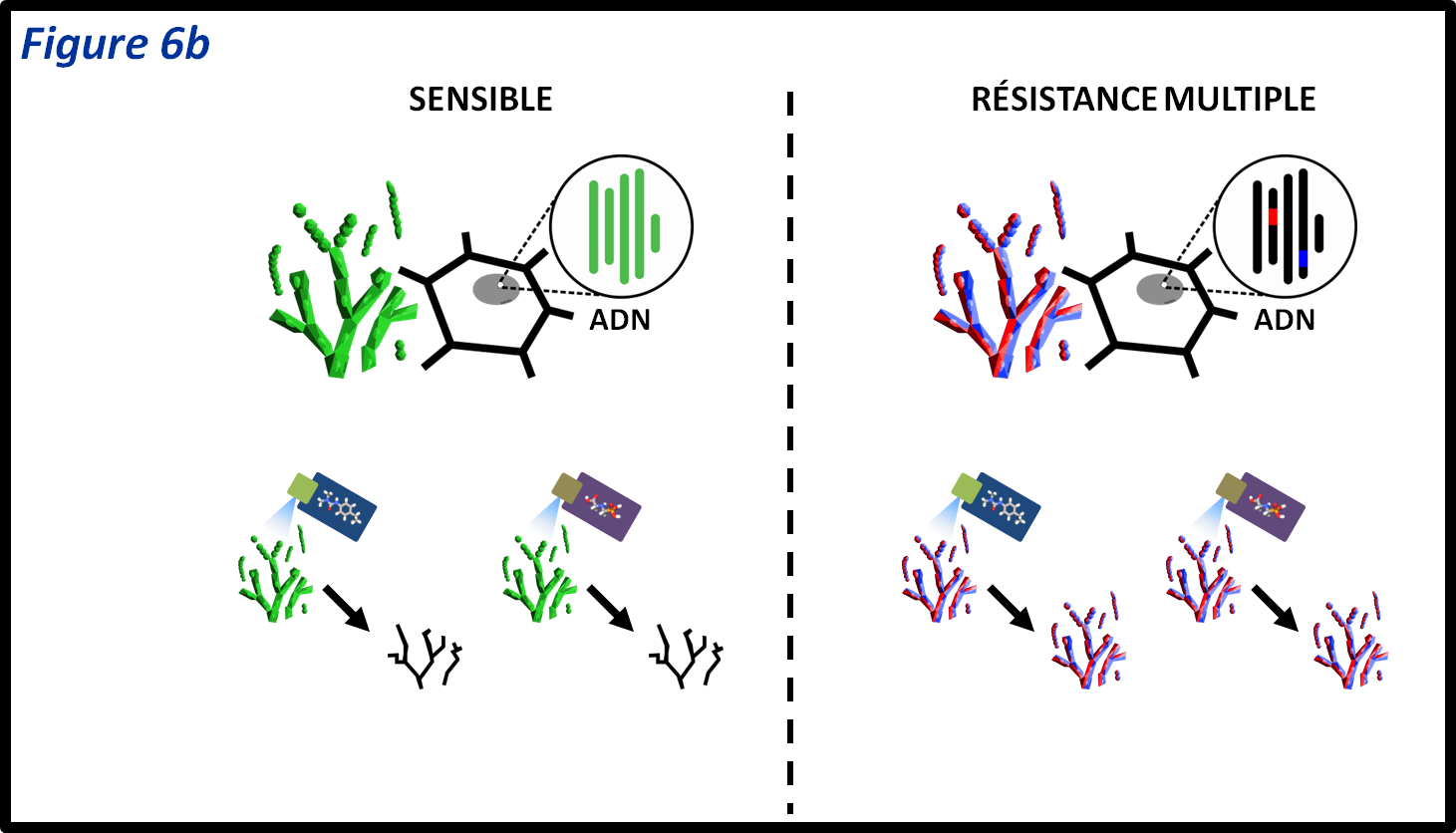
figure 6b : Lorsqu’un individu est résistant à plusieurs substances différentes à cause de plusieurs mutations, différentes pour les différentes substances actives, on parle de résistance multiple. Dans le cas théorique de ce champignon haploïde, chacune des deux mutations (rouge et bleu) confère une résistance à un PPP, et une seule. Un individu devra donc avoir les deux mutations pour être résistant aux deux PPP.
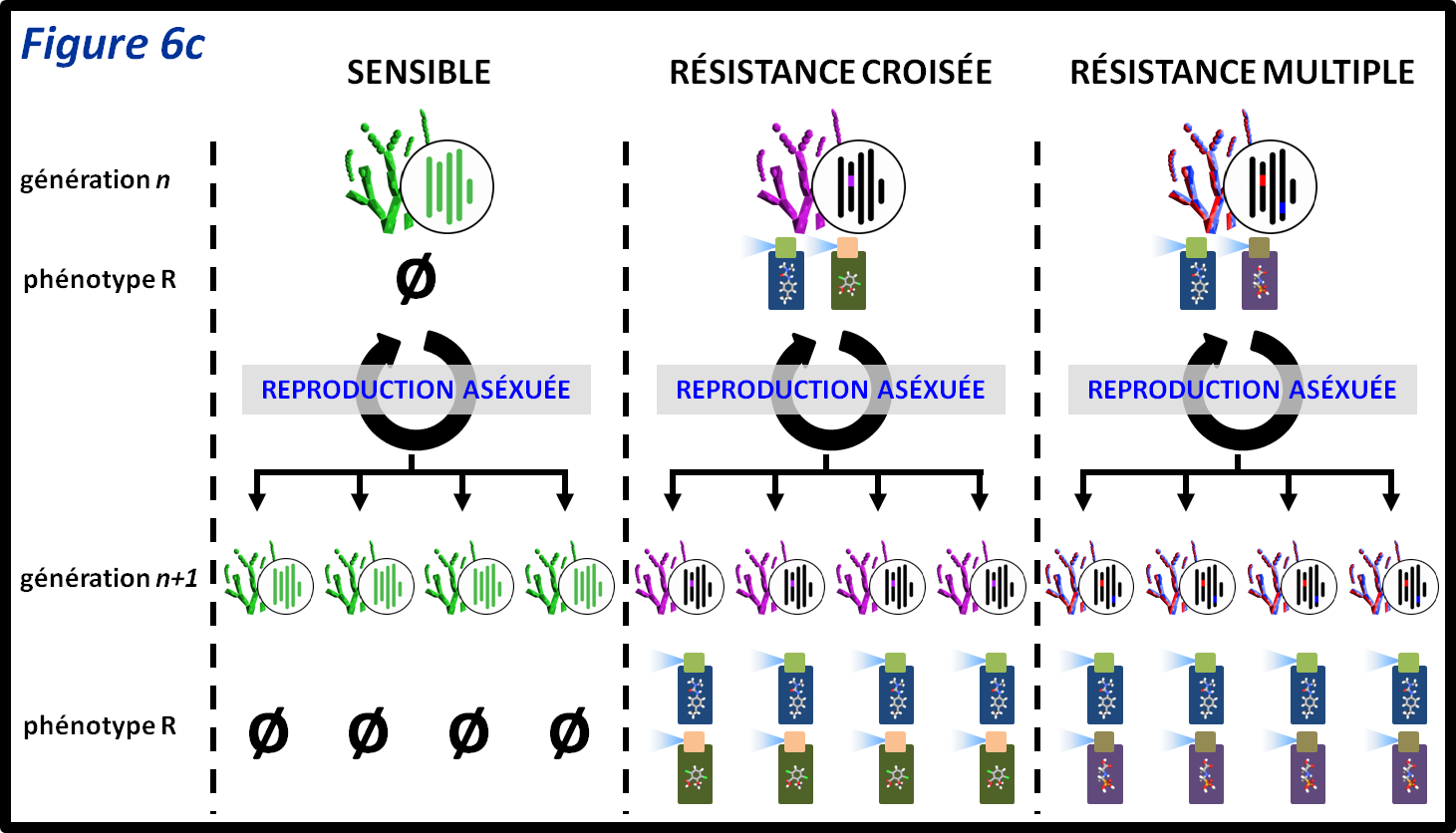
figure 6c : Lorsqu’une espèce est capable de se reproduire de manière asexuée, le spectre de résistances qu’elle porte sera transmis intégralement à sa descendance, que les résistances soient la conséquence d’une seule ou de plusieurs mutations. Dans le cas théorique de ce champignon haploïde, on voit que le phénotype de résistance est transmis en intégralité que cela soit pour la résistance croisée ou la résistance multiple. La reproduction asexuée offre la capacité aux bio-agresseurs de transmettre l’intégralité de leur génome (et donc l’intégralité de leur spectre de résistances) à leur descendance.
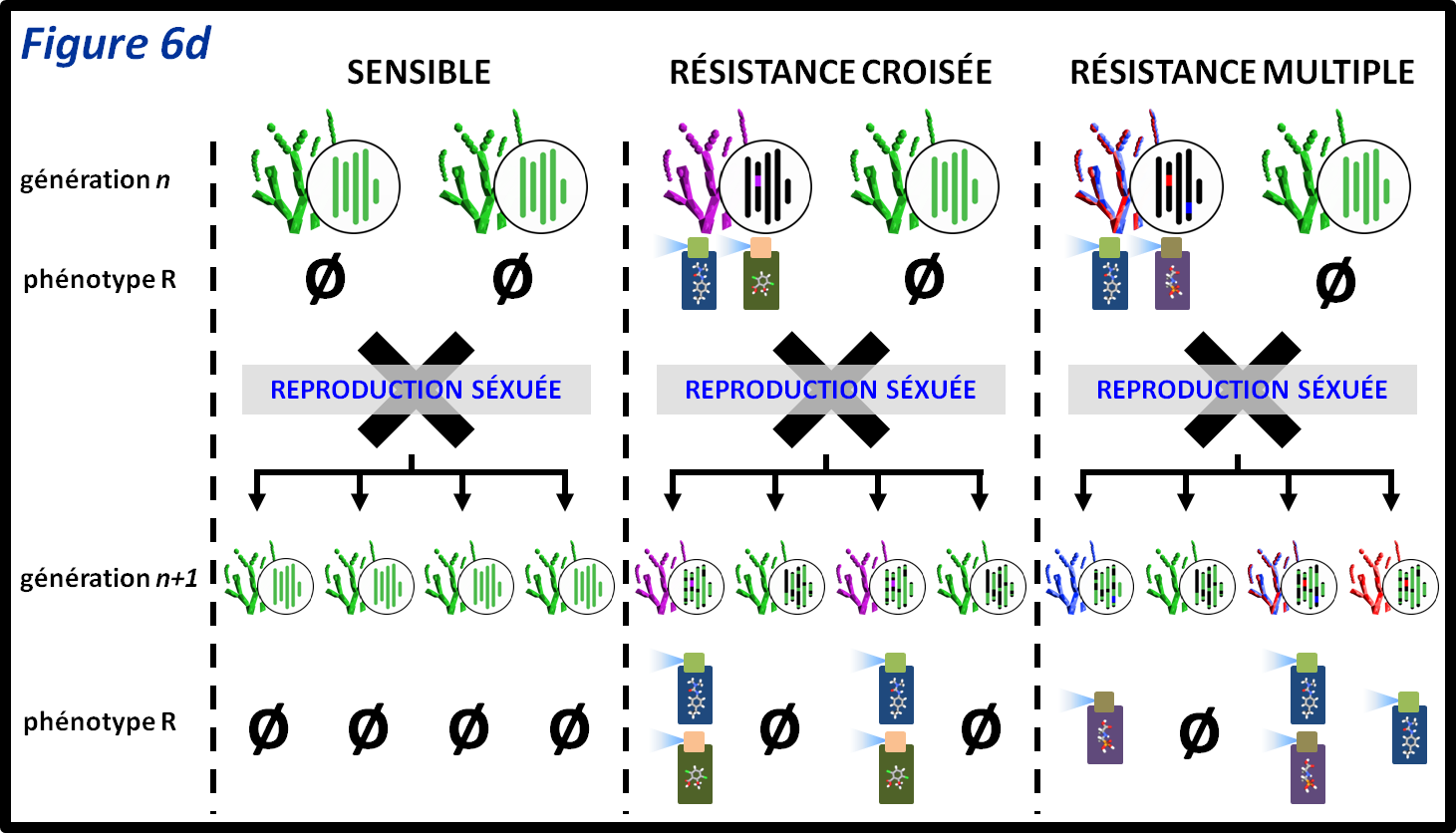
figure 6d : Lorsqu’une espèce recourt à la reproduction sexuée, seul 50% en moyenne du génome de chacun des parents est transmis à chaque individu de la génération suivante. Le spectre de résistances transmis dépendra du déterminisme génétique sous-jacent. Dans le cas théorique de ce champignon haploïde, un individu portant une résistance croisée engendrera, en se reproduisant avec un individu sensible, soit des individus avec le même spectre de résistances, soit des individus sensibles. Si le croisement a lieu entre un individu portant une résistance multiple et un individu sensible, quatre types de spectre de résistances sont possibles dans la descendance : des individus sensibles, des individus portant les deux résistances ou des individus avec l’une ou l’autre des résistances.
Les cibles des PPP sont la plupart du temps des protéines essentielles à la physiologie des bio-agresseurs. On pourrait donc s’attendre à ce qu’une mutation qui confère une résistance à un PPP puisse simultanément avoir un effet collatéral (effet pléiotrope) sur le rôle ou l’activité de la protéine. Lorsque cet effet est délétère pour le bio-agresseur, on parle de « coût génétique » associé à la résistance.
En pratique, il est difficile de démontrer et de mesurer un « coût génétique » en laboratoire. En outre, l’intensité d’un « coût génétique » varie avec les conditions environnementales, les « coûts » étant généralement plus importants quand ces conditions ne sont pas optimales ou « stressantes » pour le bio-agresseur. Il est également important de savoir qu’une résistance n’entraîne pas systématiquement un « coûts ». Dans la plupart des cas de résistances où cela a été étudié, il n’existe pas de « coût » observé. Des effets positifs de mutations associées à la résistance ont ainsi été observés sur la biologie d’adventices.
Dans les rares cas où des « coûts » ont été démontrés (essentiellement chez des pathogènes fongiques et dans quelques cas chez des adventices), les individus résistants sont moins compétitifs que les individus sensibles, et laissent donc en moyenne moins de descendants dans les populations en l’absence de traitement. L’existence de ces « coûts » peut donc être utilisée pour réduire le nombre d’individus résistants dans le cadre de stratégies de gestion des résistances.